معلومات عن اكتشاف تشريع هس يعبر تشريع هس في الكيمياء عن التشريع الذي يصف ان التحول في الطاقة في التفاعل الكيميايي الكلي يساوي مجموع التحول في الطاقة في كل طرف من اطراف التفاعل الكيميايي.[١]
اكتشاف تشريع هس
نشر تشريع هس لمجموع الحرارة من قبل العالم الكيميايي السويدي جيرمان هنري هس الوليد في عام 1840م، حيث مقال على ان الحرارة الممتصة او المتحولة في اي تفاعل كيميايي هي قيمة ثابتة ومستقلة في مجرى التفاعل الكيميايي، او في المراحل التي اجريت للحصول على التفاعل، ولكن لا يعد تشريع هس قانونا حراريا منفصلا وهذا لانه حصيلة للقانون الاول في الديناميكا الحرارية، وعلى الرغم من هذا فقد حافظ على هويته نتيجة لـ اهميته كاساس حساب درجات الحرارة في التفاعل الكيميايي.[٢]
شرح تشريع هس
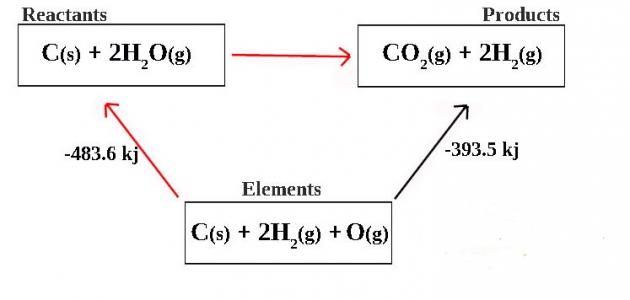
ساهم تشريع هس والذي يسمى كذلك بقانون حفظ الطاقة في تيسير كتابة المعادلة الكيميايية، بالاضافة الى تبسيط عملية تحديد قيمة التحول في الطاقة الداخلية الكامنة الكلية؛ حيث ان الطاقة الكامنة الداخلية الكلية هي اعداد الطاقة او الحرارة في المركب تحت ضغط معين، والتغير في تلك الطاقة هو مبلغ تحول الطاقة الكامنة الكلية للمواد المساهمة في التفاعل لتكوين المنتجات، ويعبر عن القيمة بالاشارة السالبة في وضعية انبعاث الطاقة، والموجبة في وضعية استهلاك الطاقة، حيث حدد التشريع ان الطاقة الداخلية الكلية تساوي مجموع الطاقة في كل طرف من اطراف التفاعل بغض البصر عن الخطوات المختلفة، والوسايط المستخدمة في التفاعل، وبذلك فانه من المحتمل تحديد التحول الكلي للطاقة الداخلية من المعادلة المقسمة على شكل: (ا+ب+ج= ا* ب*ج) عن سبيل علم قيمة التحول في طاقة التفاعل، كما يمكن حساب التحول في قيمة الطاقة الداخلية للمعادلة: (ا+ب=اب و اب+ج=ا*ب*ج) ثم جمعهما معا.[٣]